Arzneimittelqualität
Rechtliche Grundlagen
Der Beleg der erforderlichen Qualität eines humanen oder veterinären Arzneimittels ist neben dessen erwiesener Wirksamkeit und Sicherheit eine grundlegende Voraussetzung für eine Marktzulassung. Zulassungsinhaber und Hersteller sind gesetzlich dazu verpflichtet, dass die Qualität ihrer Arzneimittel, auch nach erfolgter Zulassung, immer dem neuesten Stand der Wissenschaft entspricht. Dies gilt gleichermaßen für alle Produkte, einschließlich Generika.
Die erforderliche Qualitätsdokumentation umfasst im Wesentlichen die Zusammensetzung, Entwicklung, Herstellung, Kontrolle, Verpackung und Lagerung von Fertigprodukten und Wirkstoffen, sowie ggfs. die relevante Dokumentation für Medizinprodukte bzw. Medizinproduktkomponenten, die in Kombination mit dem Arzneimittel in Verkehr gebracht werden.
Alle Qualitätsaspekte sind in Modul 3 des Dossiers abzubilden und müssen der Struktur des CTD (Common Technical Document) entsprechen, die in der EudraLex Notice to Applicants, Volume 2B vorgegeben ist.
Inhaltlich sind des Weiteren das Europäische Arzneibuch, Leitlinien, Q&A-Dokumente, u.Ä. zu berücksichtigen:
- Europäisches Arzneibuch (EP, https://pheur.edqm.eu/home), sowie das Österreichische Arzneibuch (ÖAB, Österreichisches Arzneibuch - BASG)
- Leitlinien für humane Arzneimittel
- Leitlinien für veterinäre Arzneimittel
- Q&A-Dokumente
Europäisches und Österreichisches Arzneibuch:
Das Europäische Arzneibuch legt anerkannte Qualitätsstandards für Arzneimittel und deren Bestandteile (Wirkstoffe, Hilfsstoffe, Verpackungsmaterialien) fest. Das Österreichische Arzneibuch ist eine nationale Ergänzung zum Europäischen Arzneibuch. Beide Arzneibücher sind in Österreich gemäß dem Arzneibuchgesetz per Verordnung als verbindlich erklärt.
Leitlinien:
Qualitäts-Leitlinien spiegeln einen harmonisierten Ansatz wider wie die gesetzlich festgelegten Anforderungen an den Nachweis der Qualität auszulegen und anzuwenden sind. Antragsteller und Zulassungsinhaber sind nachdrücklich aufgefordert, diese Leitlinien zu befolgen. Abweichungen von Leitlinien sind umfassend zu begründen.
Q&A-Dokumente:
Q&A-Dokumente geben den harmonisierten Standpunkt zu Fragen wieder, die unterschiedlich ausgelegt werden können oder einer Klärung bedürfen. Q&As sind in Verbindung mit dem Europäischen Arzneibuch, Qualitäts-Leitlinien, u.Ä. zu lesen.
Wirkstoffdokumentation
Inhaltlich ist Modul 3 des Zulassungsdossiers in zwei Abschnitte gegliedert, die Informationen zum Wirkstoff und zum Fertigprodukt separat behandeln. Während die Information zum Fertigprodukt immer produktspezifisch ist und im Zulassungsdossier selbst abgelegt ist, kann die Wirkstoffdokumentation auf drei Arten erfolgen:
- Vollständige Dokumentation: Die Qualitätsdokumentation für den Wirkstoff liegt vollständig im Zulassungsdossier vor.
- ASMF (active substance master file):
- Die Qualitätsdokumentation eines Wirkstoffes wird häufig in Form eines ASMFs (Active Substance Master File, ehemals DMF „Drug Master File“) eingereicht, welches die Information zur Herstellung und Kontrolle des Wirkstoffes in zwei Teile gliedert. Während der Applicant’s Part (AP) dem Antragsteller vom Wirkstoffhersteller zur Verfügung gestellt wird, um Verantwortung für die Wirkstoffqualität zu übernehmen, ist der Restricted Part (RP) nur den Behörden zugänglich. Diese physische Auftrennung dient der Geheimhaltung von geistigem Eigentum des Wirkstoffherstellers. Fragen und Defizite, die häufig im Zusammenhang mit der Einreichung und Nutzung von ASMFs aufkommen, sind in untenstehendem FAQ zusammengefasst: https://www.basg.gv.at/fuer-unternehmen/zulassung-life-cycle/faq-zulassung-life-cycle/asmf
CEP (certificate of suitability to the monograph of the European Pharmacopoeia):
Der Wirkstoffhersteller reicht dabei das Dossier mit sämtlichen Daten zur Wirkstoffherstellung beim Europäischen Direktorat für die Qualität von Arzneimitteln (EDQM) ein, wo die Begutachtung zentral erfolgt. Dies ist jedoch ausschließlich auf Wirkstoffe beschränkt, für die eine Monographie im Europäischen Arzneibuch existiert. Nach erfolgter, positiver Begutachtung wird dem Wirkstoffhersteller ein CEP ausgestellt, welches bescheinigt, dass die Qualität des Wirkstoffes ausreichend durch die entsprechende Arzneibuchmonographie kontrolliert wird. Neben rein chemischen Substanzen können auch CEPs für pflanzliche Wirkstoffe (Herbal CEPs) ausgestellt werden.
Einen Sonderfall stellen sogenannte TSE-CEPs dar, welche Substanzen mit besonderem Risiko für die Übertragung von transmissiblen spongiformen Enzephalopathien (TSE) betreffen. Darunter fallen vorwiegend Substanzen tierischen Ursprungs, wie zum Beispiel Gelatine. In diesem Fall bescheinigt das CEP, dass die Substanzen die Kriterien der Ph. Eur. Monographie 1483 “Products with risk of transmitting agents of animal spongiform encephalopathies” erfüllt.
Für weitergehende Informationen wird auf das öffentliche EDQM-Dokument „How to read a CEP“ (PA/PH/CEP (15) 31) verwiesen.
Fragen und Defizite, die häufig im Zusammenhang mit der Einreichung und Nutzung von CEPs aufkommen, sind in den FAQ zusammengefasst: www.basg.gv.at/fuer-unternehmen/zulassung-life-cycle/faq-zulassung-life-cycle/cep
Validität der Wirkstoff- und Fertigprodukthersteller
Was ist bezüglich der Validität der Wirkstoff- und Fertigprodukthersteller nach der Zulassung zu beachten?
Zulassungsinhaber haben gemäß Arzneimittelgesetz die erforderliche Qualität ihrer Arzneimittel sicherzustellen.
Sollte die Wirkstoffdokumentation durch ein Zertifikat der EDQM (CEP) abgedeckt sein, ist die kontinuierliche Gültigkeit dieses Dokuments zu gewährleisten. Werden CEPs vorübergehend ungültig gesetzt / suspendiert (Status: „suspended“) bzw. zurückgezogen (Status: "invalid"), dann sind diese als Dokumentation der erforderlichen Qualität des Wirkstoffes nicht mehr zulässig. Suspendierung bzw. Aufhebung eines CEPs können auf der EDQM Website („Actions on CEPs“) bzw. der Datenbank ("Certification") abgefragt werden.
Sinngemäß ist die Wirkstoffqualität auch im Falle der Verwendung von „Active Substance Master Files“ (ASMFs) nach GMP-Inspektionen mit negativem Ausgang nicht mehr gewährleistet. Entsprechende Non-Compliance Reports (NCRs) werden in der Eudra GMDP Datenbank publiziert.
In diesen Fällen ist aus Sicht des BASG die Qualität der betroffenen Wirkstoffe nicht mehr sichergestellt und demzufolge wird den Bestimmungen des Arzneimittelgesetzes nicht mehr Rechnung getragen.
Betrifft eine GMP-Inspektion mit negativem Ausgang einen Fertigprodukthersteller, wird als Folge ein Non-Compliance Report (NCR) in der Eudra GMDP Datenbank publiziert. Auch hier wird den Bestimmungen des Arzneimittelgesetzes nicht mehr Rechnung getragen bzw. ist aus Sicht des BASG die Qualität der betroffenen Fertigprodukte nicht mehr sichergestellt.
Welche Maßnahmen sind bei Suspendierung bzw. Aufhebung eines CEPs oder einem Non Compliance Report (NCR) für einen Wirkstoff- oder Fertigprodukthersteller zu treffen?
Im Falle einer Suspendierung bzw. Aufhebung eines CEPs bzw. in Folge einer GMP-Inspektion mit negativem Ausgang (bzw. ausgestelltem NCR) sind dem Bundesamt für Sicherheit im Gesundheitswesen (BASG) die aktuellen Hersteller für den Wirkstoff bzw. das Fertigprodukt sowie geplante weitere Maßnahmen zu übermitteln.
Erforderlichenfalls ist ein anderer/neuer Wirkstoffhersteller bzw. ein anderer/ neuer Fertigprodukthersteller inklusive entsprechender Dokumentation mittels Änderungsantrags einzureichen und durch das BASG zu genehmigen.
Rückfragehinweis
Im Falle von Rückfragen zu NCRs wenden Sie sich bitte an am-qualitaetsmangel@basg.gv.at, im Falle von Rückfragen zu betroffenen Produkten wenden Sie sich bitte an lcm@basg.gv.at.
Risikobewertung Nitrosamine in Arzneimitteln
Informationen für Zulassungsinhaber: Bewertung des Risikos möglicher Nitrosaminverunreinigungen in Humanarzneimitteln
Nitrosamine sind chemische Verbindungen, die aufgrund von Tierstudien als wahrscheinlich krebserregend für den Menschen eingestuft werden. Nachdem in verschiedenen Arzneimitteln Verunreinigungen mit Nitrosaminen festgestellt wurden, wurde im September 2019 eine wissenschaftliche Bewertung des Ausschusses für Humanarzneimittel (CHMP) gemäß Artikel 5 (3) der Verordnung (EG) Nr. 726/2004 gestartet, welche im Juli 2020 abgeschlossen wurde.
Infolgedessen wurde festgelegt, dass das Risiko für die Anwesenheit von Nitrosaminen als Verunreinigungen in humanen Arzneimitteln so weit als möglich zu verringern ist und kleiner gleich dem anzuwendenden Grenzwert liegen muss.
Des Weiteren sollen alle Zulassungsinhaber von humanen Arzneimitteln mit chemischen und biologischen Wirkstoffen diese hinsichtlich des Risikos einer möglichen Verunreinigung mit Nitrosaminen bewerten und ggfs. erforderliche Maßnahmen zu ergreifen.
Weitere Informationen finden Sie
- auf der Homepage der Europäischen Arzneimittel-Agentur “EMA - Nitrosamine Impurities“
- sowie der Koordinierungsgruppe “CMD(h) - Nitrosamine Impurities“
Praktische Vorgehensweise Österreichs hinsichtlich des Artikel 5(3) Referrals zu Nitrosaminen
Die Risikobewertung erfolgt in drei aufeinanderfolgenden Stufen
- Stufe 1 - Risikoevaluierung
- Stufe 2 - ggf. Testung
- Stufe 3 - ggf. Änderung der Zulassung
Es wird darauf hingewiesen, dass von Zulassungsinhabern erwartet wird, auch nach Übermittlung der Antworten auf Stufe 1 und/oder Stufe 2 das Ergebnis der Risikoevaluierung erneut zu überprüfen und zu überdenken, sobald neue Informationen verfügbar werden.
Generell unterscheidet sich die Vorgehensweise bei humanen Arzneimittel abhängig vom Wirkstoff:
- Chemisch synthetisierte Wirkstoffe
- Biologische Wirkstoffe
Chemisch synthetisierte Wirkstoffe
Stufe 1 – Risikoevaluierung
Das Ergebnis der Risikoevaluierung betreffend möglicher Verunreinigungen mit Nitrosaminen in zugelassenen humanen Arzneispezialitäten mit chemisch synthetisierten Wirkstoffen war dem BASG bis spätestens 31.03.2021 zu übermitteln.
Im eService wurde ein entsprechendes Verfahren für jedes betroffene Produkt angelegt. Sollte dies in Einzelfällen nicht passiert sein, kontaktieren Sie bitte nat@basg.gv.at. Dies gilt auch falls ein Risikoevaluierungsverfahren bereits abgeschlossen ist, aber aufgrund neuer Informationen eine Aktualisierung der früheren Meldung erforderlich ist.
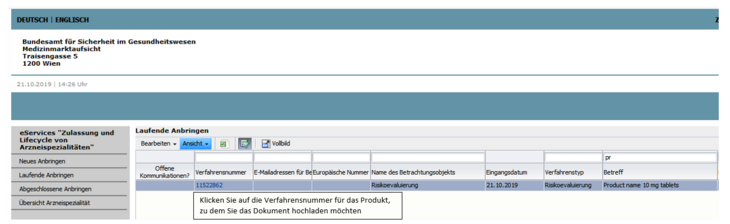
Die Bezeichnung der Arzneispezialität finden Sie im Betreff jedes betroffenen Produktes (siehe Abbildung 1).
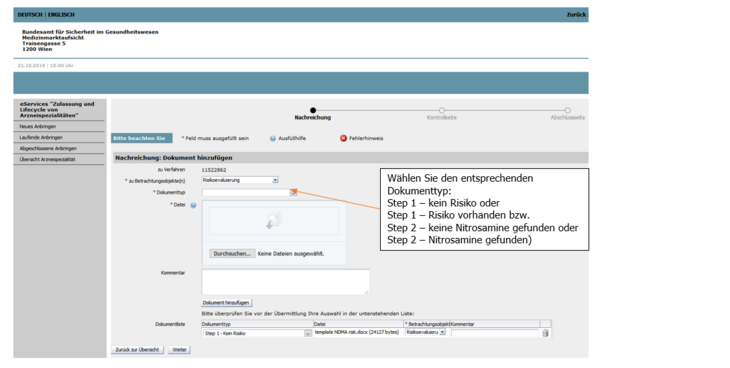
Es werden Ihnen auf der CMDh Homepage 2 Dokumente mit den jeweiligen Dokumentbezeichnungen (Step 1 - kein Risiko identifiziert, Step 1 - Risiko identifiziert) zur Verfügung gestellt.
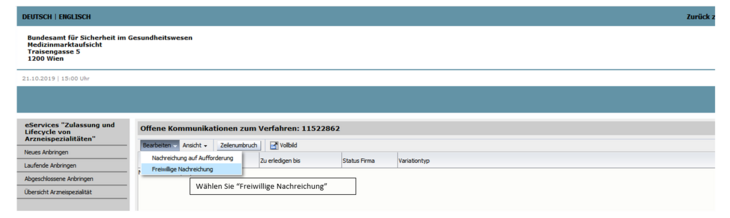
Wählen Sie bitte das für Ihr Produkt passende Dokument aus, befüllen Sie dieses vollständig und laden Sie es dann zu dem im eService bereit gestellten Verfahren mit Angabe des korrekten Dokumenttyps (Step 1 - kein Risiko identifiziert, Step 1 - Risiko identifiziert) hoch (siehe Abbildung 2 und 3).
Um die Dokumente hochzuladen, öffnen Sie das Verfahren über die jeweilige Verfahrensnummer und wählen freiwillige Nachreichung.
Die in der entsprechenden practical guidance (siehe CMDh website) angeführte Excel-Tabelle wird - wie auch dort angegeben - zum gegenwärtigen Zeitpunkt in Österreich nicht zwingend benötigt und ist daher nicht unbedingt hochzuladen.
Bitte verwenden Sie für Ihre Meldungen in Österreich ausschließlich den oben beschriebenen Ablauf.
Sollten Sie über keinen Portalzugang verfügen bzw. im Fall von Fragen, kontaktieren Sie bitte .
Stufe 2 - Testung
CAVE: nur relevant, wenn in Step 1 ein Risiko identifiziert wurde.
Im eService wurde bezüglich Step 1 ein entsprechendes Verfahren für jedes betroffene Produkt angelegt und – sollte ein Risiko identifiziert worden sein – ist dieses Verfahren offen verblieben.
Es werden Ihnen von CMDh 2 Dokumente mit den jeweiligen Dokumentbezeichnungen (Step 2 - keine Nitrosamine gefunden, Step 2 - Nitrosamine gefunden) zur Verfügung gestellt.
Wählen Sie bitte das für Ihr Produkt passende Dokument aus, befüllen Sie dieses vollständig und laden Sie es dann zu dem im eService bereit gestellten Verfahren mit Angabe des korrekten Dokumenttyps (Step 2 - keine Nitrosamine gefunden, Step 2 - Nitrosamine gefunden) hoch (siehe Abbildung 2 und 3).
Um die Dokumente hochzuladen, öffnen Sie das Verfahren über die jeweilige Verfahrensnummer und wählen freiwillige Nachreichung.
Bitte verwenden Sie für Ihre Meldungen in Österreich ausschließlich den oben beschriebenen Ablauf.
Stufe 3 - etwaige Änderungen der Arzneispezialität
Aufgrund der Risikobewertung erforderliche Änderungen waren bis 01.10.2023 einzureichen.
CAVE:
Bitte beachten sie, dass die festgelegten Fristen für die Risikobewertung (Stufe 1, 2 und 3), wie oben beschrieben, abgelaufen sind. Alle Zulassungsinhaber von humanen Arzneimitteln mit chemischen Wirkstoffen, welche identifizierte Verunreinigungen mit Nitrosaminen noch nicht berichtet haben, sollen dies vorrangig machen, einschließlich etwaiger Aktualisierungen früherer Meldungen.
Biologische Wirkstoffe
Stufe 1 - Risikoevaluierung
Sollte ihre biologische Arzneispezialität einer Risikoevaluierung betreffend möglicher Verunreinigungen mit Nitrosaminen bedürfen, war das Ergebnis der Risikoevaluierung dem BASG bis spätestens 01.07.2021 zu übermitteln.
Im eService wurde ein entsprechendes Verfahren für jedes betroffene Produkt angelegt. Sollte dies in Einzelfällen nicht passiert sein, kontaktieren Sie bitte . Die Bezeichnung der Arzneispezialität finden Sie im Betreff jedes betroffenen Produktes (siehe Abbildung 1).
Es werden Ihnen von CMDh 2 Dokumente mit den jeweiligen Dokumentbezeichnungen (Step 1 - kein Risiko identifiziert, Step 1 - Risiko identifiziert) zur Verfügung gestellt.
Wählen Sie bitte das für Ihr Produkt passende Dokument aus, befüllen Sie dieses vollständig und laden Sie es dann zu dem im eService bereit gestellten Verfahren mit Angabe des korrekten Dokumenttyps (Step 1 - kein Risiko identifiziert, Step 1 - Risiko identifiziert) hoch (siehe Abbildung 2 und 3).
Um die Dokumente hochzuladen, öffnen Sie das Verfahren über die jeweilige Verfahrensnummer und wählen freiwillige Nachreichung.
Die in der entsprechenden practical guidance (siehe CMDh website) angeführte Excel-Tabelle wird - wie auch dort angegeben - zum gegenwärtigen Zeitpunkt in Österreich nicht zwingend benötigt und ist daher nicht unbedingt hochzuladen.
Bitte verwenden Sie für Ihre Meldungen in Österreich ausschließlich den oben beschriebenen Ablauf.
Sollten Sie über keinen Portalzugang verfügen bzw. im Fall von Fragen, kontaktieren Sie bitte .
Stufe 2 - Testung
CAVE: nur relevant wenn in Step 1 ein Risiko identifiziert wurde.
Im eService wurde bezüglich Step 1 ein entsprechendes Verfahren für jedes betroffene Produkt angelegt und - sollte ein Risiko identifiziert worden sein – ist dieses Verfahren offen verblieben.
Es werden Ihnen von CMDh 2 Dokumente mit den jeweiligen Dokumentbezeichnungen (step 2 - keine Nitrosamine gefunden, step 2 - Nitrosamine gefunden) zur Verfügung gestellt.
Wählen Sie bitte das für Ihr Produkt passende Dokument aus, befüllen Sie dieses vollständig und laden Sie es dann zu dem im eService bereit gestellten Verfahren mit Angabe des korrekten Dokumenttyps (step 2 - keine Nitrosamine gefunden, step 2 - Nitrosamine gefunden) hoch (siehe Abbildung x und y).
Um die Dokumente hochzuladen, öffnen Sie das Verfahren über die jeweilige Verfahrensnummer und wählen freiwillige Nachreichung.
Bitte verwenden Sie für Ihre Meldungen in Österreich ausschließlich den oben beschriebenen Ablauf.
Stufe 3 – etwaige Änderungen betreffend ihrer Arzneispezialität
Aufgrund der Risikobewertung erforderliche Änderungen waren bis 01.07.2023 einzureichen.
CAVE:
Bitte beachten sie, dass die festgelegten Fristen für die Risikobewertung (Stufe 1, 2 und 3), wie oben beschrieben, abgelaufen sind. Alle Zulassungsinhaber von humanen Arzneimitteln mit biologischen Wirkstoffen, welche identifizierte Verunreinigungen mit Nitrosaminen noch nicht berichtet haben, sollen dies vorrangig erledigen, einschließlich etwaiger Aktualisierungen früherer Meldungen.
Rückfragen:
E-Mail: nat@basg.gv.at
Rückfragen (für Medien): Kommunikationsmanagement, Tel.: 050555/25000
E-Mail: presse-basg@basg.gv.at
Qualitätsmängel
Informationen zur Meldung von Qualitätsmängeln finden Sie unter Meldewesen.