FAQ Vertriebseinschränkungen
1. Gibt es eine Möglichkeit für vertriebsberechtigte Unternehmen oder einen externen Service Partner die Meldepflicht zu übernehmen?
Für lokale Niederlassungen von Zulassungsinhabern bzw. vertriebsberechtigte Unternehmen, die in der Gebrauchsinformation gelistet und eindeutig zugeordnet werden können, oder vom Zulassungsinhaber bevollmächtigte Person(en) oder bevollmächtigtes Unternehmen, gibt es die Möglichkeit, die Rolle „Melder Vertriebseinschränkung“ für das eService „Zulassung & Lifecycle ASP“ zu beantragen. Wenden Sie sich für die Ausübung der Funktion mit folgenden Unterlagen an medicineshortage@basg.gv.at:
- Liste der zu betreuenden Arzneispezialitäten
- (entweder) Aktuelle Gebrauchsinformationen, aus denen hervorgeht, dass Antragsteller*innen als örtliche Vertretung des pharmazeutischen Unternehmens gelistet sind
- (oder) Vom Zulassungsinhaber ausgestellte Vollmacht an das betraute Unternehmen, diese Funktion für die genannten Arzneispezialitäten ausüben zu dürfen
2. Bezieht sich die Einschränkung der Vertriebsfähigkeit auf jede einzelne Packungsgröße? Muss die Meldung gemacht werden, wenn eine andere Packungsgröße verfügbar wäre?
Sobald eine Einschränkung der Vertriebsfähigkeit einer verschreibungspflichtigen Arzneispezialität zur Deckung des Bedarfs der Patientinnen und Patienten im Inland nicht mehr gegeben ist, muss eine Meldung erfolgen. Die Meldung sowie die einzugebenden Daten basieren immer auf Ebene der Arzneispezialität, umfassen also sämtliche Packungsgrößen der zugelassenen Arzneispezialität. Im Zuge der Meldung ist der Status der Verfügbarkeit („nicht verfügbar“, „eingeschränkt verfügbar“, „verfügbar“, „nicht vermarktet“) für jede Packungsgröße der Arzneispezialität anzugeben. Falls nicht alle Packungsgrößen in Österreich vermarktet werden (z.B. es gibt keine PZN-Nummer), so ist der Status für diese auf „nicht vermarktet“ zu setzen.
3. Wie ist „nicht ausreichende Verfügbarkeit“ zu definieren?
Als Einschränkung der Vertriebsfähigkeit gilt eine über voraussichtlich vier Wochen hinausgehende nicht ausreichende Verfügbarkeit einer verschreibungspflichtigen Arzneispezialität zur Deckung des Bedarfs der Patientinnen und Patienten im Inland. Die angemessene und kontinuierliche Bereitstellung der Arzneispezialität für die Abgabe durch Apotheken oder für sonst zur Abgabe gemäß § 59 Arzneimittelgesetz idgF. Berechtigte ist über diesen Zeitraum nicht sichergestellt.
4. Was bedeutet bei der Meldung der Status „nicht verfügbar“, „eingeschränkt verfügbar“, „verfügbar“, „nicht vermarktet“?
Bei jeder Zulassung einer Arzneispezialität werden diverse Packungsgrößen zugelassen. Nicht jede wird tatsächlich in Österreich in Verkehr gebracht.
„nicht verfügbar“ bedeutet: Die Packungsgröße der Arzneispezialität kann nicht mehr von Apotheken in Österreich abgegeben werden.
„eingeschränkt verfügbar“ bedeutet: Die Packungsgröße der Arzneispezialität kann nicht mehr kontinuierlich und in ausreichendem Maße von Apotheken in Österreich abgegeben werden.
„verfügbar“ bedeutet: Die Packungsgröße der Arzneispezialität kann kontinuierlich und in ausreichendem Ausmaß von Apotheken in Österreich abgegeben werden.
„nicht vermarktet“ bedeutet: Die Packungsgröße der Arzneispezialität ist zwar zugelassen, wurde aber noch nie in Österreich in Verkehr gebracht.
5. Wie geht man mit Produkten um, die zwar zugelassen aber nicht auf dem Markt sind?
Nicht vermarktete Packungsgrößen einer Arzneispezialität müssen bei der Meldung als „nicht vermarktet“ eingetragen werden.
Ist eine Arzneispezialität mit all seinen zugelassenen Packungsgrößen jedoch noch niemals in Österreich in Verkehr gebracht worden oder wird nicht mehr in Verkehr gebracht, ist keine Meldung als Vetriebseinschränkung notwendig, aber im eService "Zulassung & Lifecycle ASP" bei den Vermarktungsangaben einzutragen.
6. Sind Tierarzneimittel von der Meldeverordnung erfasst?
Nein, der Anwendungsbereich der Verordnung über die Sicherstellung der Arzneimittelversorgung umfasst nur verschreibungspflichtige Humanarzneispezialitäten.
7. Müssen auch zentrale Zulassungen gemeldet werden?
Ja, zentrale Zulassungen, die der Verschreibungspflicht unterliegen, müssen gemeldet werden.
8. Wie lange hat das BASG Zeit, eine nicht verfügbare oder eingeschränkt verfügbare Arzneispezialität zu veröffentlichen?
Die Bearbeitung innerhalb der Geschäftszeiten des BASG erfolgt grundsätzlich unverzüglich. Durch ein hohes Meldeaufkommen und die individuelle Prüfung jeder einzelnen Meldung kann sich die Bearbeitungszeit verlängern. Die Meldungen werden nach erfolgreicher Bearbeitung durch das BASG immer am Tag danach in den öffentlichen Registern publiziert.
9. Wie prüft das BASG, ob für eine Arzneispezialität ein Exportverbot in den EWR ausgesprochen wird?
Die Überprüfung erfolgt anhand des Entscheidungsbaumes (siehe Grafik), der unter anderem die Pflichtfelder „Anzahl der betroffenen Patientinnen und Patienten“, „Marktabdeckung“, „Verkaufszahlen“, „errechneter Bedarf“, „Lagerbestand“ sowie „verfügbare potentielle alternative Arzneimittel“ berücksichtigt.
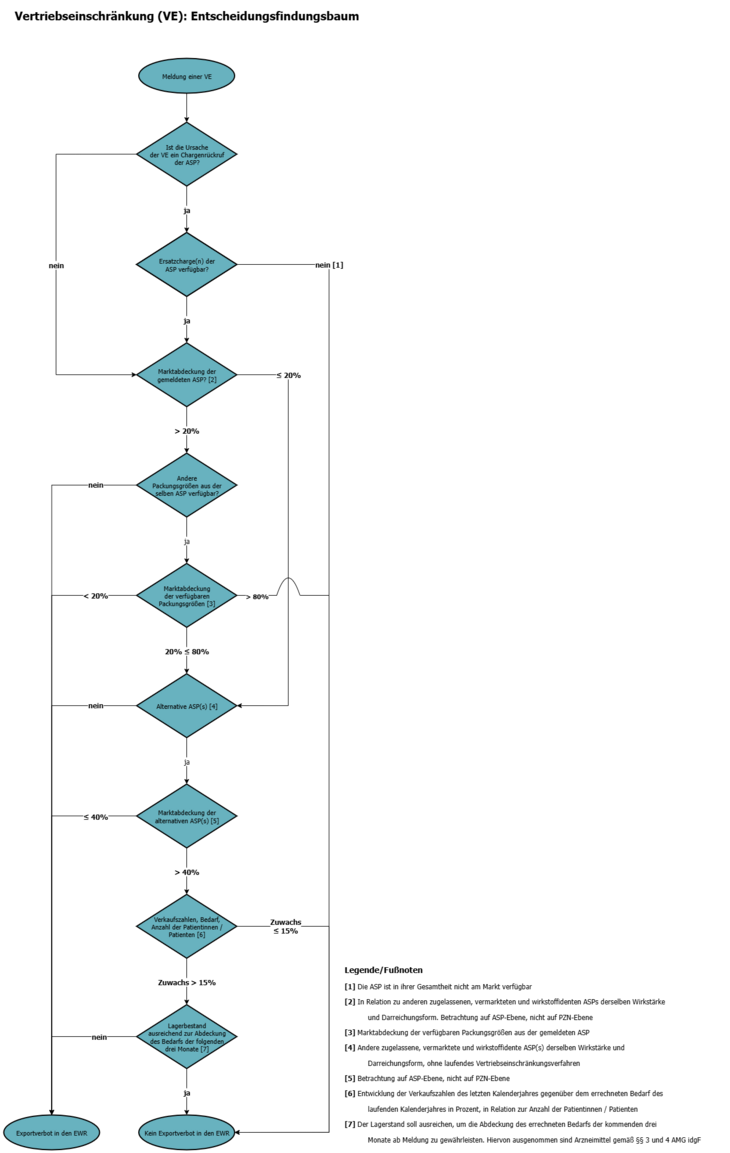
10. Müssen im neuen Meldesystem auch alte, vor dem 1. April 2020 bereits erfolgte Meldungen noch einmal eingetragen werden?
Die alten Meldungen werden in das neue System überführt. Falls die Notwendigkeit besteht, dass seitens des BASG mit dem Zulassungsinhaber bzw. der Melderin /dem Melder Kontakt aufgenommen werden muss oder umgekehrt, um ein etwaiges Parallelexportverbot prüfen zu können, müssen die neuen Pflichtfelder „Anzahl der betroffenen Patientinnen und Patienten“, „Marktabdeckung“, „Verkaufszahlen“, „errechneter Bedarf“, „Lagerbestand“ sowie „verfügbare potentielle alternative Arzneimittel“ nachgereicht werden.
11. Wie geht man mit Arzneispezialitäten um, die schon seit Monaten nicht lieferbar sind, müssen diese auch gemeldet werden?
Ja, jede Einschränkung der Vertriebsfähigkeit einer verschreibungspflichtigen Arzneispezialität im Inland ist unverzüglich zu melden.
12. Was ist zu tun, wenn ein Zulassungsinhaber ausreichend liefern kann, es aber trotzdem zu Meldungen von Apotheken und Patientinnen und Patienten kommt, dass die Arzneispezialität nicht lieferbar ist?
Hier findet § 4 Abs. 1 der Verordnung zur Sicherstellung der Arzneimittelversorgung Anwendung. Bitte wenden Sie sich mit einer Sachverhaltsdarstellung an medicineshortage@basg.gv.at und machen vorab keine Meldung über das eService Portal bzw. nur in Absprache mit dem BASG.
13. Was ist zu tun, wenn ein Zulassungsinhaber nicht mehr liefern kann, weil der Marktführer ausgefallen ist und somit unverschuldet in den Lieferausfall gerät?
Hier findet § 4 Abs. 1 der Verordnung zur Sicherstellung der Arzneimittelversorgung Anwendung. Bitte wenden Sie sich mit einer Sachverhaltsdarstellung an medicineshortage@basg.gv.at und machen vorab keine Meldung über das eService Portal bzw. nur in Absprache mit dem BASG.
14. Was ist zu tun, wenn ein Zulassungsinhaber die auf Lager befindliche Ware kontingentieren muss, um die Versorgung sicherstellen zu können und Bevorratung oder den Export in den EWR zu vermeiden?
Im Falle einer Kontingentierung einer verschreibungspflichtigen Human-Arzneispezialität im Inland ist jedenfalls eine Vertriebseinschränkung zu melden und dieser Umstand im Feld „Kommentar“ im Meldesystem mitzuteilen. Bei der Kontingentierung trifft eine nicht ausreichende bzw. eingeschränkte Verfügbarkeit zu.
15. Wie ist im Falle eines Exportverbots in den EWR vorzugehen, wenn es für das Arzneimittel gemeinsame Packmittel für mehrere Länder gibt (Mehrländeraufmachungen)?
Packungen mit einer "Mehrländeraufmachung" dürfen nicht aus Österreich in den EWR exportiert werden, da der Zulassungsinhaber diese für Österreich bestimmt und in Österreich in Verkehr gebracht hat.
16. Welche Konsequenz gibt es bei Versäumnis einer entsprechenden Meldung zur Nicht-Lieferbarkeit/Einschränkung der Vertriebsfähigkeit?
Erlangt das BASG Kenntnis davon, dass der Zulassungsinhaber seinen Verpflichtungen gemäß der Verordnung über die Sicherstellung der Arzneimittelversorgung nicht oder teilweise nicht nachkommt, hat das BASG amtswegig eine entsprechende Überprüfung einzuleiten (siehe dazu § 3 der Verordnung über die Sicherstellung der Arzneimittelversorgung). Ein Verstoß gegen die Verordnung über die Sicherstellung der Arzneimittelversorgung stellt gemäß § 84 Abs. 1 Z 23 Arzneimittelgesetz eine Verwaltungsübertretung dar und ist mit Geldstrafe bis zu 25 000 Euro, im Wiederholungsfalle bis zu 50 000 Euro zu bestrafen.
17. Ist die Gebühr pro Meldung, pro Arzneispezialität oder pro Pharmazentralnummer (PZN) zu entrichten?
Die Gebühr ist pro Meldung der Arzneispezialität und nicht pro gemeldeter Packungsgröße zu entrichten. Die Höhe der Gebühr entnehmen Sie bitte dem aktuellen Gebührentarif. Die Gebühr ist für Meldungen ab 1. Juli 2020 zu entrichten.
18. Können pro Arzneispezialität mehrere Unternehmen die Rolle „Melder Vertriebseinschränkung“ übernehmen?
Um eine übersichtliche Bearbeitung und die Nachvollziehbarkeit gewährleisten zu können, wird die Rolle „Melder Vertriebseinschränkung“ nur ein Mal pro Arzneispezialität vergeben.
19. Sind Parallelimporte und Paralleldistributionen von der Verordnung erfasst?
Arzneispezialitäten, für die entweder eine Genehmigung für den Vertrieb im Parallelimport besteht oder eine Paralleldistribution nach Prüfung durch die Europäische Arzneimittelagentur (EMA) gewährt wurde, sind nach der Verordnung über die Sicherstellung der Arzneimittelversorgung nicht meldepflichtig.
20. Was versteht man unter einem Exportverbot in den EWR?
Gemäß § 5 Abs. 1 der Verordnung über die Sicherstellung der Arzneimittelversorgung ist aus Gründen des Schutzes der öffentlichen Gesundheit der Export in eine andere Vertragspartei des Europäischen Wirtschaftsraums verboten. Ausgenommen davon ist die Ausfuhr für eine einzelne namentlich bekannte Patient:in zur unmittelbaren Abwehr einer Lebensbedrohung oder einer schweren gesundheitlichen Schädigung („Named Patient Use“). Drittstaaten sind vom Exportverbot in den EWR ausgenommen.
21. Ist eine Vertriebseinschränkungsmeldung vorzunehmen, wenn die Deckung des Bedarfs der Patientinnen und Patienten im Inland mit Ware aus dem EWR bzw. einem Drittland kompensiert werden kann?
Sofern eine Einschränkung der Vertriebsfähigkeit im Sinne des § 1 Abs. 1 Verordnung über die Sicherstellung der Arzneimittelversorgung für die in Österreich zugelassene Arzneispezialität vorliegt, ist jedenfalls eine Meldung an das BASG vorzunehmen, unabhängig von einer darüberhinausgehenden Verbringung bzw. einem Import von Arzneiwaren, die ursprünglich nicht für den österreichischen Markt bestimmt waren.
22. Muss eine verschreibungspflichte Arzneispezialität gemeldet werden, welche in Österreich für die Erteilung eines CPPs (Certificate for a Pharmaceutical Product) lagert?
Für eine verschreibungspflichtige Arzneispezialität, welche in Österreich für die Erteilung eines CPPs (Certificate for a Pharmaceutical Product) lagert und nicht zur Deckung des Bedarfs der Patientinnen und Patienten im Inland bestimmt ist, ist keine Vertriebseinschränkungsmeldung vorzunehmen.
23. Was ist im Falle einer Marktrücknahme (vorübergehende oder endgültige Einstellung des Inverkehrbringens) bei einer laufenden Vertriebseinschränkungsmeldung zu tun?
Mit der AMG-Novelle vom 14.02.2022 und der damit verbundenen Änderung des § 21 (2) AMG idgF ist dem BASG eine vorübergehende oder endgültige Einstellung des Inverkehrbringens von Arzneispezialitäten nunmehr vier Monate (anstatt bisher zwei Monate) im Vorhinein zu melden (siehe auch die Kurzmeldung vom 14.02.2022). Die Meldung ist (wie bisher) über das eService abzugeben und seitens des BASG gemäß § 21 (4) AMG idgF zu veröffentlichen.
Für bereits gemeldete Vertriebseinschränkungen bedeutet das:
- Bei einer endgültigen Einstellung des Inverkehrbringens kann die Vertriebseinschränkung aus den Registern entfernt werden. Das Verfahren wird eingestellt.
- Bei einer temporären Einstellung des Inverkehrbringens bleibt die bestehende Vertriebseinschränkung aufrecht bzw. muss diese neu angelegt werden. Bitte wenden Sie sich mit einer Sachverhaltsdarstellung, ob es sich bei einer bestehenden Vertriebseinschränkung um eine vorübergehende oder endgültige Einstellung handelt, an medicineshortage@basg.gv.at.
24. Muss eine Vertriebseinschränkung bei einer vorübergehenden oder endgültigen Einstellung des Inverkehrbringens gemeldet werden?
- Bei einer endgültigen Einstellung des Inverkehrbringens ist keine Meldung einer Vertriebseinschränkung notwendig.
- Bei einer temporären Einstellung des Inverkehrbringens ist zusätzlich eine Vertriebseinschränkung zu melden.
| Vertriebseinschränkung melden | Marktrücknahme melden | |
| endgültige Einstellung | nein | ja |
| vorübergehende Einstellung | ja | ja |
| keine Einstellung, aber Vertriebseinschränkung | ja | nein |
25. Was ist zu tun, wenn es bei einer laufenden Vertriebseinschränkungsmeldung zu einem Wechsel des Zulassungsinhabers oder des Meldeberechtigten kommt?
Eine Zulassungsübertragung oder Änderung an der Rolle „Melder Vertriebseinschränkung“ wird nicht automatisch in das laufende Vertriebseinschränkungsverfahren übernommen. Es ist notwendig, dass die Änderung des Zulassungsinhabers bzw. des Meldeberechtigten schriftlich an medicineshortage@basg.gv.at gemeldet wird. Außerdem ist eine ordnungsgemäße Übergabe des laufenden Verfahrens an den neuen Zulassungsinhaber mit allen erforderlichen Informationen zur korrekten Darstellung der Vertriebseinschränkung sicherzustellen.
