Chargenfreigabe
Was ist die Chargenfreigabe?
Für bestimmte Arzneispezialitäten muss eine Chargenfreigabe durch ein österreichisches behördliches Arzneimittelkontrolllabor (Official Medicinal Control Laboratory, OMCL) vorliegen, bevor diese in Verkehr gebracht werden dürfen.
Für Arzneispezialitäten, die in Österreich zugelassen sind, können auch Chargenfreigabezertifikate von anderen OMCLs innerhalb der EU/EWR-Staaten und der Schweiz anerkannt werden, wenn die Zulassung im Freigabeland mit der österreichischen Produktspezifikation übereinstimmt.
Folgende Arzneispezialitäten, die zur Anwendung am Menschen vorgesehen sind, fallen unter diese Bestimmungen:
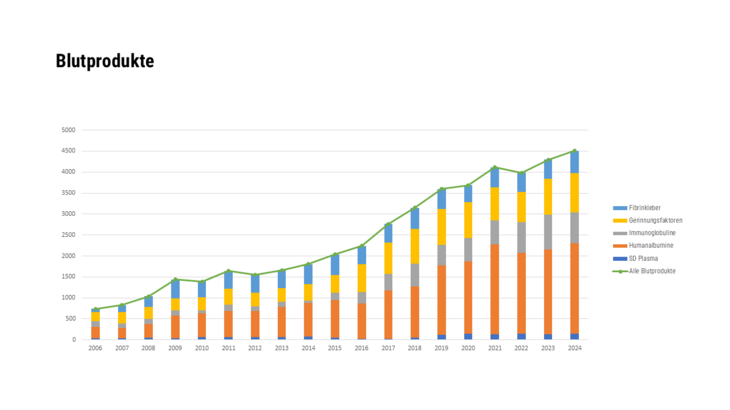
- Arzneispezialitäten, die unter Verwendung von menschlichem Blut oder Blutplasma als Ausgangsstoff hergestellt wurden
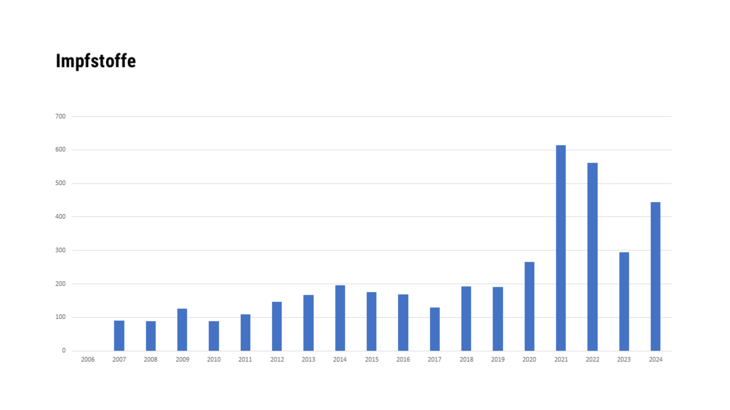
- Immunologische Arzneispezialitäten, die aus Impfstoffen, Toxinen, Sera oder Allergenen bestehen, soweit es sich dabei um
- Lebendimpfstoffe
- für die Primärimmunisierung von Kleinkindern oder anderen Risikogruppen verwendete Arzneimittel
- bei Immunisierungsprogrammen im Rahmen des öffentlichen Gesundheitswesens verwendete Arzneimittel, oder um
- Arzneispezialitäten handelt, die neu zugelassen oder mit Hilfe neuartiger Techniken hergestellt werden oder für eine bestimmte Herstellerin/einen bestimmten Hersteller neu sind. Diese Arzneispezialitäten unterliegen der Chargenfreigabe für einen näher zu bestimmenden Übergangszeitraum. Diese Arzneispezialitäten müssen vom Bundesamt für Sicherheit im Gesundheitswesen per Bescheid zugelassen werden
- Die Chargenfreigabepflicht gilt auch für Arzneispezialitäten, die für die Anwendung am oder im Tier gedacht sind, sofern es sich dabei um immunologische Arzneispezialitäten, die aus Impfstoffen, Toxinen, Sera oder Allergenen bestehen und zur Abwehr von anzeigepflichtigen Tierseuchen gemäß Tierseuchengesetz bestimmt sind.
Wen betrifft die Chargenfreigabe?
- Unternehmen, die eine Bewilligung des Bundesamt für Sicherheit im Gesundheitswesen zur Herstellung, Kontrolle oder Vertrieb von Arzneimitteln vorweisen können
- Unternehmen, die in einer Vertragspartei des EWR zur Herstellung, Kontrolle oder Vertrieb von Arzneimitteln berechtigt sind
- Arzneiwareneinfuhr (inklusive für Klinische Studien)
Welche Arzneimittel sind chargenprüfungspflichtig?
Human
§26. (1) Der Chargenfreigabe unterliegen folgende für die Anwendung am oder im Menschen bestimmte Arzneispezialitäten:
- Arzneispezialitäten, die unter Verwendung von menschlichem Blut oder Blutplasma als Ausgangsstoff hergestellt wurden, sowie
- immunologische Arzneispezialitäten, die aus Impfstoffen, Toxinen, Sera oder Allergenen bestehen, soweit es sich dabei um
- Lebendimpfstoffe,
- für die Primärimmunisierung von Kleinkindern oder anderen Risikogruppen verwendete Arzneimittel,
- bei Immunisierungsprogrammen im Rahmen des öffentlichen Gesundheitswesens verwendete Arzneimittel, oder um
- Arzneispezialitäten handelt, die neu zugelassen oder mit Hilfe neuartiger Techniken hergestellt werden oder für einen bestimmten Hersteller neu sind. Diese Arzneispezialitäten unterliegen der Chargenfreigabe für einen näher zu bestimmenden Übergangszeitraum.
Veterinär
Tierarzneimittelgesetz §23.
(1) Der Chargenfreigabe unterliegen für die Anwendung am oder im Tier bestimmte immunologische Veterinärarzneispezialitäten, die aus Impfstoffen, Toxinen, Sera oder Allergenen bestehen und zur Abwehr von anzeigepflichtigen Tierseuchen gemäß §2 Abs. 1 Tiergesundheitsgesetz 2024, BGBl. I Nr. 53/2024 bestimmt sind.
(2) §26 AMG ist sinngemäß anzuwenden.
Wie erhält man eine Chargenfreigabe?
Soll eine Charge in Verkehr gebracht werden, müssen zuerst das entsprechende, ausgefüllte Antragsformular, die vollständige Dokumentation und genügend Probenmaterial dem OMCL übermittelt werden.
Ab September 2022 gibt es ein neues Portal, über das Chargenfreigaben beantragt werden können. Unter https://eservices.basg.gv.at können berechtigte Benutzer ihre Anträge unkompliziert einbringen. Nähere Informationen können Sie bei chargen@basg.gv.at erfragen! Zu den eServices erhalten Sie unter diesem Link nähere Informationen.
Anschließend werden alle notwendigen Parameter gemäß OCABR Guidelines für das jeweilige Produkt im Labor getestet. Die Chargendokumentation wird durch Gutachterinnen/Gutachter auf Vollständigkeit und Richtigkeit gemäß der Zulassung überprüft.
Nach Erhalt des vollständigen Antrags, der anstandslosen Überprüfung der Charge durch Gutachterinnen/Gutachter und Labor wird die Chargenfreigabe in Form eines Zertifikates genehmigt.
Formulare
Bitte stellen Sie Ihre Anträge über das Portal unter https://eservices.basg.gv.at. Sollten Sie Ihr Produkt nicht finden, nehmen Sie mit chargen@basg.gv.at oder verwenden Sie in dringenden Fällen zur ersten Einreichung eines der folgenden Formulare.
- Kontaktpersonen für Chargenfreigaben und Notifikationen01.11.2018
- 10.06.2024
- 01.11.2018
Spezielle Serviceleistungen zu Verkürzung und Vereinfachung der Chargenfreigabe
Paralleleinreichung
Der Antragsteller kann die Proben zur Chargenfreigabe vorab zur Testung mit Antragsformular ohne vollständige Chargendokumentation einreichen. Die Testung der geforderten Parameter erfolgt parallel bei Antragsteller und OMCL. Ab Einreichen der gesamten Chargendokumentation erfolgt die Chargenfreigabe gewöhnlich innerhalb eines Arbeitstages.
Elektronische Einreichung der Chargendokumentation
Die Dokumente für die Chargenfreigabe können einfach über das Portal oder per eMail übermittelt werden.
Zertifikat für ein Zwischenprodukt
Chargendokumente für Hilfsstoffe können ohne Proben eingereicht werden. Für die Austellung des Hilfsstoffzertifikats fällt keine Gebühr an.
Elektronische Übermittlung der Freigabezertifikate
Um das Inverkehrbringen der Chargen für den Antragsteller zu verkürzen, können Zertifikate per eMail oder FAX vorab übermittelt werden, bevor das Original per Post oder Botendienst zugestellt wird.
Exportzertifikat
Auch für Chargen, die außerhalb der EU auf den Markt gebracht werden sollen, können Exportzertifikate ausgestellt werden.
Kundengespräche
Auf Anfrage können gerne zielgerichtete Kundengespräche geführt werden, um Prozesse zu optimieren und auf Kundenwünsche einzugehen.
Rechtliche Grundlagen und Guidelines für die Chargenfreigabe
Verknüpfung zum Rechtsinformationssystem (RIS) des Bundeskanzleramtes
- Klinikfreigaben laut Arzneimittelgesetz §8
- Anzeigepflichtige Seuchen laut Tierseuchengesetz §16
- Chargenfreigabe laut Arzneimittelgesetz §26
Verknüfung auf die Website des Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM)