FAQ Online Service Zulassung & Lifecycle ASP
1. Welche Vorteile hat die Nutzung des eServices „Zulassung und Lifecycle von Arzneispezialitäten“ und ist die Nutzung verpflichtend?
Das eService vereinfacht die Kommunikation zwischen Unternehmen und Behörden bei Zulassungs- und Änderungsverfahren von Arzneispezialitäten. Alle Verfahren sind zentral aufgelistet, Nachforderungen sind verfahrensbezogen aufgelistet.
Nachreichungsschreiben können einfach übermittelt werden. Eine Nutzung des eService "Zulassung und Lifecycle Arzneispezialitäten" ist derzeit nicht verpflichtend, jedoch wird die Kommunikation seit 01.07.2013 primär darüber abgewickelt.
2. Ist diese Plattform auch für zentrale Zulassungen gedacht?
Nein.
3. Werden über das eService "Zulassung und Lifecycle Arzneispezialitäten" auch Bescheide elektronisch zugestellt?
Die elektronische Zustellung von Bescheiden erfolgt über akkreditierte Zustelldienste lt. Zustellgesetz.Weitere Informationen finden Sie auf der Unternehmensservice Portal-Seite .
4. Wann sollen Dokumente über das eService "Zulassung und Lifecycle Arzneispezialitäten" übermittelt werden?
Das eService „Zulassung und Lifecycle Arzneispezialitäten“ soll für den Austausch österreichischer Produktinformationstexte genutzt werden.
Übermittlung österreichischer Produktinformations-Texte
Die österreichischen Produktinformations-Texte sollen entweder als Working Documents (WD) übermittelt oder falls nur Österreich betroffen ist (bei MR/DC-Verfahren in der nationalen Phase und generell bei nationalen Verfahren) über das eService „Zulassung und Lifecycle Arzneispezialitäten“ hochgeladen werden.
Für die Übermittlung von Dossiers und Dossierteilen gehen Sie bitte wie folgt vor:
Übermittlung Dossiers
Für Einreichungen von Dossiers bei nationalen oder MR/DC-Verfahren verwenden Sie bitte die Common European Submission Plattform (CESP) bzw. DVD/CDs.
Nachreichung/Responses von Dossierteilen
Verwenden Sie bitte die Common European Submission Plattform (CESP) bzw. DVD/CDs.
5. Wie soll ich Produktinformations-Texte während des Verfahrens mit der Behörde austauschen?
Für den Austausch von Texten (FI/GI/KE), die ausschließlich Österreich betreffen (bei MR/DC-Verfahren in der nationalen Phase und generell bei nationalen Verfahren), verwenden Sie bitte das eService „Zulassung und Lifecycle Arzneispezialitäten“.
Wir ersuchen Sie, keine ZIP-Dateien hochzuladen. Sind mehrere Länder betroffen (während MR/DC-Verfahren), wird die Verwendung des Common European Submission Plattform (CESP) empfohlen, da mit einer Übertragung Texte an mehrere Länder übermittelt werden können.
6. Muss man immer wieder in das Portal nachsehen oder wird man per E-Mail über neue Dokumente informiert?
Eine E-Mail-Benachrichtigung wird bei Anlage eines Verfahrens, bei einem neuen Kommunikationseintrag und bei Abschluss eines Verfahrens versendet. Die Empfängerliste kann durch den Administrator der Organisation bearbeitet werden. Für weitere Informationen siehe:
- 27.07.2021
7. Ist es im eService "Zulassung und Lifecycle Arzneispezialität" bei Kommunikationseinträgen ersichtlich, um welches Produkt es sich handelt?
Ja, es ist ersichtlich, welche Produkte betroffen sind. Bitte beachten Sie, dass nur laufende Verfahren aufgelistet werden.
8. Kann man für jedes Produkt separate Benutzerrechte vergeben?
Eine Rechtevergabe auf Produktebene ist nicht vorgesehen.
9. Sollen hier nur PDFs hochgeladen werden oder können das auch Worddokumente sein?
Es sind alle MS-Office Formate sowie PDFs erlaubt. Bei den Dokumenttypen „Fachinformation (barrierefrei)“ und „Gebrauchsinformation (barrierefrei)“ sind ausschließlich PDFs erlaubt.
10. In welchem Datenformat sollen die Texte bei nationalen Änderungsverfahren hochgeladen werden?
Die von der jeweiligen Änderung betroffenen Texte sollen als änderungsmarkierte Word-Files hochgeladen werden.
11. Wie kann ich bestimmen, was Konsulenten im eService „Zulassung und Lifecycle Arzneispezialitäten“ sehen?
Hier ist zwischen folgenden Fällen zu entscheiden:
Fall A - Konsulentenmitarbeiter sollen ALLE laufenden Verfahren des Auftraggebers sehen
Mitarbeiter des Konsulenten als Mitarbeiter des Auftraggebers in der „Benutzer- und Rechteverwaltung“ eintragen.
Fall B - Konsulentenmitarbeiter sollen NUR EINZELNE laufende Verfahren sehen
Angabe der Konsulentenorganisation im Antragsformblatt als „Anbringer“ oder „Bevollmächtigter während/nach des Verfahrens“. Zuordnung der Konsulentenmitarbeiter NUR in der Konsulentenorganisation.
12. Benötigt mein Unternehmen einen lokalen Ansprechpartner in Österreich, um sich für den eService "Zulassung und Lifecycle Arzneispezialität" zu registrieren?
Da Sie Ihr Unternehmen über das Internet mit dem Webbrowser registrieren können, ist ein lokaler Ansprechpartner in Österreich nicht notwendig. Weitere Informationen finden Sie in der FAQ Registrierung und Portal. Dort finden Sie eine ebenfalls Anleitung.
Nach erfolgreicher Registrierung erhält der Administrator der Organisation ein Dokument mit den Zugangsdaten. Die BASG/AGES Medizinmarktaufsicht erlaubt es Ihnen, einen Administrator pro Organisation zu benennen. Der Administrator kann in der Folge weiteren Mitgliedern seiner Organisation den Zugang zu allen anhängigen Verfahren der Organisation ermöglichen.
13. Erfolgt die Diskussion der österreichischen Produktinformationstexte mit dem Bundesamt für Sicherheit im Gesundheitswesen (BASG)/AGES Medizinmarktaufsicht auch über diese Plattform?
Die Plattform dient jeglicher Kommunikation in der nationalen Phase nach MR-/DC-Verfahren sowie bei nationalen Verfahren.
Hier finden Sie einen Leitfaden für die Verwendung des eService "Zulassung und Lifecycle ASP".
Wenn Sie zu einem laufenden Verfahren Dokumente hochladen wollen, klicken Sie bitte auf die entsprechende Verfahrensnummer, dann auf "freiwillige Nachreichung" und wählen im Dropdown Menü die Art des Dokumentes aus.
Anschließend können Sie die Texte hochladen. Gegebenenfalls können Sie das Dokument mit einem kurzen Kommentar versehen. Bitte beachten Sie jedoch die maximal zulässige Zeichenlänge von 500 Zeichen. Möchten Sie längere Kommentare schicken, empfiehlt es sich, diese in einem gesonderten Dokument hochzuladen.
14. Wie kann ich eine Nachreichung zu bereits beendeten Verfahren an die Behörde senden?
Nachreichungen zu beendeten Verfahren können nur via CD/DVD/CESP und nicht mehr über das eService eingereicht werden.
15. Wo finde ich Informationen zu elektronischen Antragsformblättern?
Hier finden Sie nähere Informationen zu elektronischen Antragsformblättern (eAFs) und deren Anwendung.
16. Mein Verfahren wird im eService nicht aufgelistet
Bitte stellen Sie sicher, dass Sie nach der Anmeldung die richtige Organisation ausgewählt haben. Sollten Sie diese Firma nicht auswählen können, nehmen Sie bitte mit dem Administrator der jeweiligen Firma Kontakt auf.
Wenn Sie das Verfahren vor weniger als 7 Tagen über CESP geschickt haben, kann es sein, dass das Verfahren noch nicht angelegt ist. Bitte haben Sie noch ein wenig Geduld, Ihr Verfahren wird im System so bald wie möglich angelegt.
Wenn die Einreichung über CESP schon länger her ist als 7 Tage, wenden Sie sich zur Klärung, warum das Verfahren nicht angezeigt wird, bitte an die Bearbeiterin/den Bearbeiter laut Zuteilungsschema. Bitte geben Sie dabei folgende Angaben an:
- Login (E-Mail-Adresse)
- Organisation Nr. und Name
- Name der Arzneispezialität
- CESP-Submission ID
- Zulassungsnummer
- Einreichdatum
- EU-Verfahrensnummer
17. Neue Spalte „Risikoklasse“ zeigt keinen Wert an
Seit 13.10.2021 ist im eService „Zulassung und Lifecycle Arzneispezialitäten“ eine neue Spalte mit der Bezeichnung „Risikoklasse“ in der „Übersicht Arzneispezialitäten“ zu finden. Diese ist derzeit noch leer und dient der Vorbereitung für eine spätere Anzeige der Risikoklassifizierung hinsichtlich der Versorgungskritikalität der jeweiligen Arzneispezialität. Über die weitere Vorgehensweise wird zeitgerecht informiert werden.
18. Warum ist der ZIP-Ordner bei meinem abgeschlossenen Verfahren leer?
Der ZIP Ordner, der bei Klick auf den „download zip“ –Button erzeugt wird, enthält die mit dem ausgewählten Verfahren genehmigten Fach- und Gebrauchsinformationen, barrierefreien Fach- und Gebrauchsinformationen, Kennzeichnungen und Mock-ups sowie ggf. den Approval Letter, den Bescheid, den PAR (Public Assessment Report), die finale Stellungnahme zum nationalen PSUR und die finale Stellungnahme zur nationalen PSUR-Zyklusänderung. Wurde im Verfahren keines dieser Dokumente genehmigt bzw. erzeugt, ist auch der ZIP-Ordner leer.
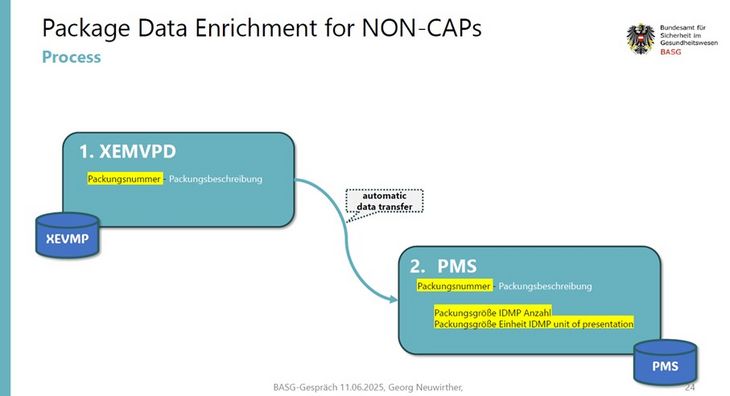
20. Wofür wird der Export der Packungsdaten bereitgestellt?
Das BASG/AGES MEA stellt Packungsdaten bereit, damit die notwendige Anreicherung von Packungsdaten in XEVMPD und PMS unterstützt werden kann.
Es wird empfohlen die Anreicherung in XEVMPD folgendermaßen vorzunehmen: Empfohlene Syntax: Packungsnummer - Beschreibung
Beispiel: 957917002 -Tabletten in Streifen (Papier-PE-Aluminium-Copolymerfolie).
Dies erleichtert MAHS und dem BASG/AGES MEA die Identifikation der nach PMS transferierten Packungen.
Die Verwendung der Packungsnummer ist nicht verpflichtend.