Hinweise zur Vorbereitung auf die Verordnung (EU) 536/2014
Trainingsmaterial der Europäischen Arzneimittelagentur
Die Europäische Arzneimittelagentur (EMA) bietet umfangreiches Trainingsmaterial zur Vorbereitung auf die Verordnung (EU) 536/2014 ("Clinical Trials Regulation, CTR") sowie die Arbeit im Clinical Trials Information System (CTIS) an.
Allgemeine Information zur Clinical Trials Regulation (CTR)
Trainingsmaterial zum Clinical Trials Information System (CTIS)
Das Trainingsmaterial wird laufend aktualisiert und umfasst
- Online-Schulungsmodule
- das Handbuch für Sponsoren von klinischen Prüfungen
- Referenzmaterialien für Sponsoren von klinischen Prüfungen
- Referenzmaterialien für Behörden
- Schulungs- und Informationsveranstaltungen (inklusive Videos)
- Information zu Master-Trainern von Sponsoren, Behörden und Ethikkommissionen
Das Studium dieses Trainingsmaterials ist mit allem Nachdruck zu empfehlen, bevor eine Klinische Prüfung via CTIS eingereicht wird.
Benutzerverwaltung der EMA
- Um im Clinical Trials Information System (CTIS) Aktionen vornehmen zu können (z.B. einen Antrag zu stellen), müssen Sie im Account Management System der EMA registriert sein. Es handelt sich um eine Selbstregistrierung, die allen offensteht.
- Sobald Sie ein EMA-Konto haben, können Sie im Namen Ihrer Organisation Zugang zu EMA-Anwendungen wie CTIS, SPOR, IRIS, EudraVigilance und UPD beantragen.
- Ist Ihre Organisation noch nicht bei der EMA registriert, können Sie dies selbst im Organisation Management Service (OMS) der EMA vornehmen. Bedingung ist, dass Sie von Ihrer Organisation dazu berechtigt sind, was von der EMA bei der Anlage überprüft wird.
Die EMA hat 2022 Schulungen zum OMS durchgeführt, deren Aufzeichnungen hier verfügbar sind.
Wichtig für Prüfzentren!
Auch Prüfzentren müssen im OMS der EMA als Organisationen registriert sein, um bei einem Antrag auf Klinische Prüfung ausgewählt werden zu können. Dabei geht es nicht um die einzelne Abteilung, sondern die übergeordnete Organisationseinheit der klinischen Einrichtung.
Ein potentielles Prüfzentrum muss dem Sponsor/Antragsteller daher vor Antragstellung in CTIS seine Organisation ID (ORG ID) sowie den Namen und die Abteilung des Prüfers/der Prüferin übermitteln, damit es in CTIS als Prüfzentrum gewählt werden kann.
Für komplexe Organisationseinheiten wird empfohlen, die Registrierung der Organisation zentral zu koordinieren (z.B. durch die ärztliche Direktion oder den Rektor). Beim Administrator der Organisation sollte es sich um dieselbe Person handeln, die gemäß Annex I, Buchstabe N, der Verordnung für die Bescheinigung der Eignung der klinischen Einrichtung als Prüfstelle verantwortlich ist (wobei diese Verantwortung natürlich delegiert werden kann.)
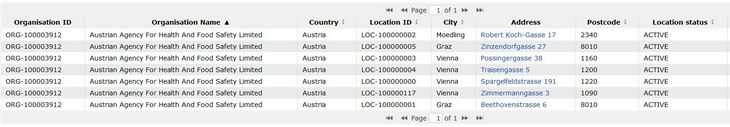
Am untenstehenden Beispiel der Agentur für Gesundheit und Ernährungssicherheit (AGES) sieht man, dass die AGES Medizinmarktaufsicht (AGES MEA) in der Traisengasse, obwohl sie einen eigenen Standort hat, Teil der übergeordneten AGES ist. Im Falle eines Prüfzentrums wäre die AGES MEA die Abteilung und die AGES die klinische Einrichtung.